von René Lesnik
Wirtszellaustritt intrazellulärer Pathogene – das DFG-Schwerpunktprogramm SPP 2225
Welche Auslöser zu einem Wirtszellaustritt bei humanen Krankheitserregern führen und welche Strategien und molekularen Mechanismen im Laufe der Evolution dazu entwickelt wurden, ist seit 2021 Thema des Schwerpunktprogramms SPP 2225 der Deutschen Forschungsgemeinschaft DFG. Ziel des Programms ist es, interdisziplinäre Forschung zu bündeln um Gemeinsamkeiten dieser Austrittsstrategien zu finden und molekulare Angriffspunkte für neue Medikamente zu identifizieren.

Warum ist der Austritt aus der Wirtszelle so wichtig?
Viele einzellige Krankheitserreger leben und vermehren sich im Laufe ihrer Entwicklung innerhalb menschlicher Zellen. Dazu gehören so unterschiedliche Organismen wie der Malaria-Erreger Plasmodium falciparum, bestimmte Bakterien, zum Beispiel Salmonellen, und Hefepilze. In ihren Wirtszellen finden sie Zugang zu Nährstoffen und sind vor den Angriffen unseres Immunsystems geschützt. Um sich auszubreiten und neue Zellen zu besiedeln, müssen diese Pathogene jedoch den Schutz ihrer Wirtszelle irgendwann wieder verlassen.
Dieser Wirtszellaustritt, im englischen „exit“ genannt, ist entscheidend für Krankheitsentwicklung und -ausbreitung. Für den Erreger ist es aber auch ein riskantes Manöver. Wird er freigesetzt, macht er sich angreifbar für die körpereigene Abwehr; bleibt er in der zellulären Umgebung, unterbricht er seinen Entwicklungszyklus.
Welche Strategien sind bekannt?
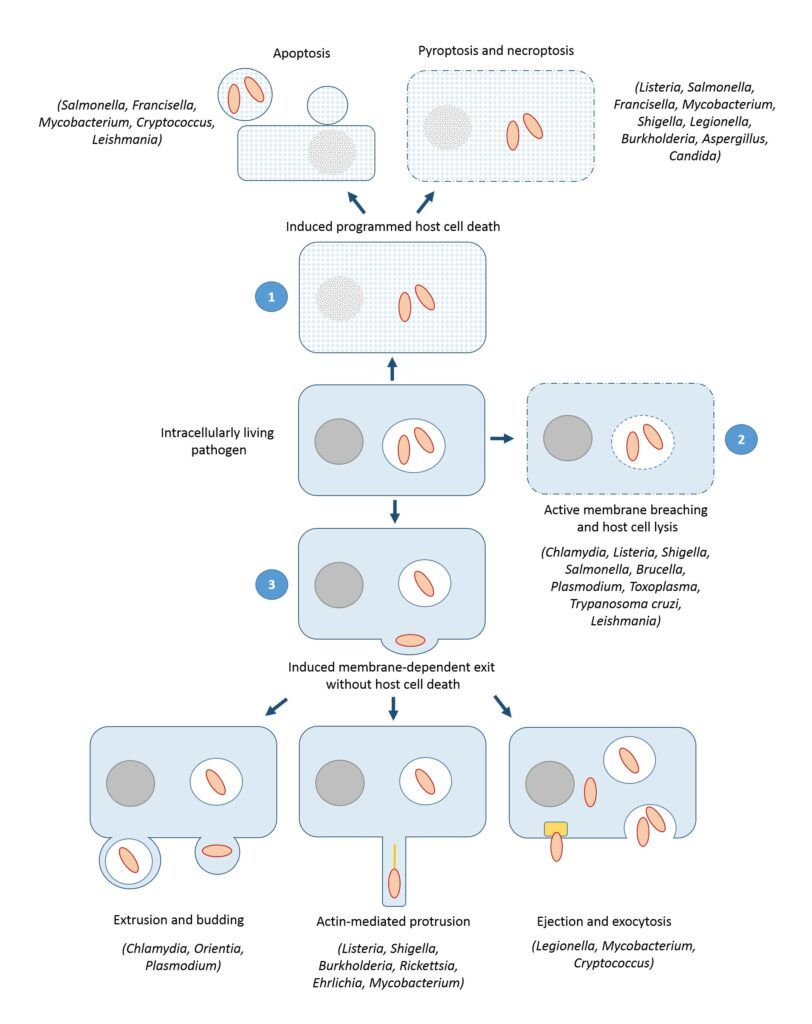
Die Wissenschaft unterscheidet drei prinzipielle Wege, auf denen Erreger ihre Wirtszelle verlassen:
1. Apoptose
Mit der Einleitung der Apoptose startet der Krankheitskeim den Selbstzerstörungsmechanismus der Zelle. Eine Zelle zerstört sich zum Beispiel selbst, wenn sie von Krankheitserregern befallen ist oder wenn sich ein Fehler in ihren Reproduktionszyklus eingeschlichen hat. Dieser ganz genau definierte Prozessablauf wird streng reguliert, sodass es zu keiner ungewollten Selbstausschaltung kommt.
2. Lyse
Bei der aktiven lytischen Zerstörung der Wirtszelle schüttet der Erreger Moleküle aus, die zur Auflösung der Zellmembranen führen. Dadurch werden Zellbestandteile freigelegt, die zu Entzündungsreaktionen führen können. Eine Lyse findet immer durch Fremdeinwirkung statt.
3. Exocytose
Es gibt auch einen membranabhängigen Austritt ohne Auflösung der Wirtszelle. Hier werden wirtszelleigene Strukturen und Prozesse ausgenutzt, zum Beispiel Aktinfilamente oder Exocytose. Als Exocytose wird ein natürlicher Vorgang bezeichnet, bei dem die Zelle Material aus ihrem Inneren nach außen verfrachtet. Dabei sind vor allem Membranen und das Zytoskelett beteiligt.
Eine gute deutschsprachige Zusammenfassung dieser einzelnen Strategien und der Motivation zum Schwerpunktprogramm SPP 2225 finden Sie in diesem Open-Access-Artikel von BIOspektrum.
Schlüssel zu neuen Medikamenten
Interessanter Weise bedienen sich fast alle intrazellulären, menschlichen Krankheitserreger einem oder mehrerer dieser Austrittswege. Es liegt also eine konvergente Entwicklung bei evolutionsgeschichtlich sehr unterschiedlichen Organismen vor. Dies lässt vermuten, dass ganz bestimmte Moleküle maßgeblich an diesen Prozessen beteiligt sind. Solche Schlüsselmoleküle stellen attraktive Ziele für neuartige Wirkstoffe und die Entwicklung neuer Behandlungsmethoden dar. Dies verhindert zwar keine Erstinfektion, aber es hemmt die Vermehrung und Ausbreitung der Erreger, wodurch der Körper Gelegenheit hat eine adäquate Immunantwort aufzubauen.
Schlüssel zum Erfolg: Interdisziplinäre Forschung
Die Erforschung solch komplexer Prozesse erfordert die Expertise von Spezialisten und Spezialistinnen aus den diversesten Fachbereichen sowie modernes technologisches Know-how. Daher fördert das DFG-Schwerpunktprogramm SPP 2225 Projekte aus der medizinischen Mikrobiologie, Parasitologie und Infektionsbiologie sowie technologische Service-Plattformen zur Datenerzeugung und -analytik.
Die einzelnen Arbeitsgruppen arbeiten an den Bakterien Mycobacterium, Coxiella, Salmonella, Legionella und Staphylococcus, an den einzelligen Parasiten Toxoplasma, Leishmania und Plasmodium sowie an pathogenen Hefepilzen der Gattung Candida. Technologie-Plattformen der Proteomik und Lipidomik liefern analytische Unterstützung um die Identität und Interaktion einzelner mikrobieller und zellulärer Faktoren aufzuklären. Ein weiteres Projekt bündelt moderne licht- und elektronenmikroskopische Verfahren um die Abläufe und Prozesse des Wirtszellaustritts unter die Lupe zu nehmen. Sogenannte „Omics“ sind molekularbiologische Fachbereiche, die sich der ganzheitlichen Betrachtung einer bestimmten Art von Zellbausteinen widmen. Die Proteomik analysiert zum Beispiel alle Proteine einer Probe und die Lipidomik die Fettsäuren oder Lipide.
Einige Wissenschaftler:innen des SPP 2225 sowie ihre Forschungsfragen können Sie auf dem YouTube-Kanal des Schwerpunktprogramms kennenlernen (der Link führt extern zu Youtube).
Infect-Net-Initiatorin Gabriele Pradel ist Programm-Sprecherin
Um die einzelnen Arbeitsgruppen und Projekte zusammenzubringen und den fruchtbaren Austausch von Daten und Methodik zu ermöglichen, ist eine effiziente Koordination essentiell. Die Koordinationsstelle befindet sich an der RWTH Aachen und wird von der Arbeitsgruppe Zelluläre und Angewandte Infektionsbiologie betreut. Deren Leiterin, Gabriele Pradel, ist erfahrene Infektionsbiologin und Sprecherin des Schwerpunktprogramms. Zu ihrem Ausschussteam gehören zudem ihre Infect-Net-Partnerin Antje Flieger vom Robert Koch-Institut, Friedrich Frischknecht, Sascha Brunke und Mathias Hornef.
Aktuell läuft die Bewertung neuer Projekte, eine Übersicht über bereits eingereichte und geförderte Projekte gibt es bei der DFG.
Weiterführende Links